RNA-Medizin
Einst unterschätzt, jetzt Hoffnungsträger
In der Corona-Pandemie stellten mRNA-Impfstoffe ihre Wirksamkeit und Sicherheit unter Beweis. Mit ihnen beginne eine neue Ära in der Medizin, sagt der Würzburger Infektionsbiologe Jörg Vogel. Er beschreibt den Siegeszug der Ribonukleinsäure in der Therapie bei der GDNÄ-Festversammlung in Leipzig – und hier im Interview.
Herr Professor Vogel, ein Themenschwerpunkt der Jubiläumstagung in Leipzig ist die RNA-Medizin. Was macht die neue Therapierichtung so interessant?
Die begründete Hoffnung, dass bisher unheilbare Krankheiten endlich behandelt werden können. Auslöser waren die großartigen Erfolge der mRNA-Impfstoffe in der Corona-Pandemie. Die Impfstoffe konnten nicht nur sehr schnell entwickelt werden, sie haben sich auch als hochwirksam und sicher erwiesen. Weltweit herrscht derzeit eine unglaubliche Aufbruchstimmung, manche sprechen sogar von einer medizinischen Revolution. Jetzt geht es darum, das Wirkprinzip auf möglichst viele Krankheiten zu übertragen.
Welche Krankheiten kommen dafür infrage?
Grenzen gibt es da kaum. Die Forschung konzentriert sich aktuell auf Krebs und Herz-Kreislauf-Erkrankungen. Aber auch andere Volkskrankheiten wie die Demenz sind mögliche Kandidaten. Und bei zahlreichen seltenen Erkrankungen, vor allem wenn sie auf Defekte in einem einzelnen Gen zurückgehen, könnte die RNA-Medizin endlich den Durchbruch bringen. Einige RNA-Medikamente sind in der EU bereits auf dem Markt und ich rechne schon bald mit vielen neuen Therapien.
Die RNA scheint ein Alleskönner zu sein. Wie schafft sie das?
Das hat mit ihren vielen Fähigkeiten zu tun, die lange übersehen wurden. Früher konzentrierte sich fast alles auf die Messenger-RNA, kurz: mRNA, ein Botenmolekül, das genetische Baupläne aus dem Zellkern zu den Proteinfabriken im Zytosol bringt. Neben der ebenfalls schon länger bekannten tRNA, die Aminosäuren zu den Proteinfabriken, den Ribosomen, transportieren, und der rRNA, die ein Bestandteil dieser Proteinfabriken ist, hat man in den letzten Jahren viele weitere RNA-Klassen entdeckt. Sie erhielten Namen wie miRNA für micro RNA oder siRNA für small interfering RNA. Inzwischen sind mehr als ein Dutzend verschiedene RNA-Klassen bekannt, und es kommen ständig neue hinzu. Klar ist heute: RNA steuert lebenswichtige Prozesse in den Zellen und Fehler bei dieser Steuerung können Krankheiten verursachen. Oder, um ein bisschen zu übertreiben: Die RNA ist der wahre Akteur in unseren Zellen und Organen.
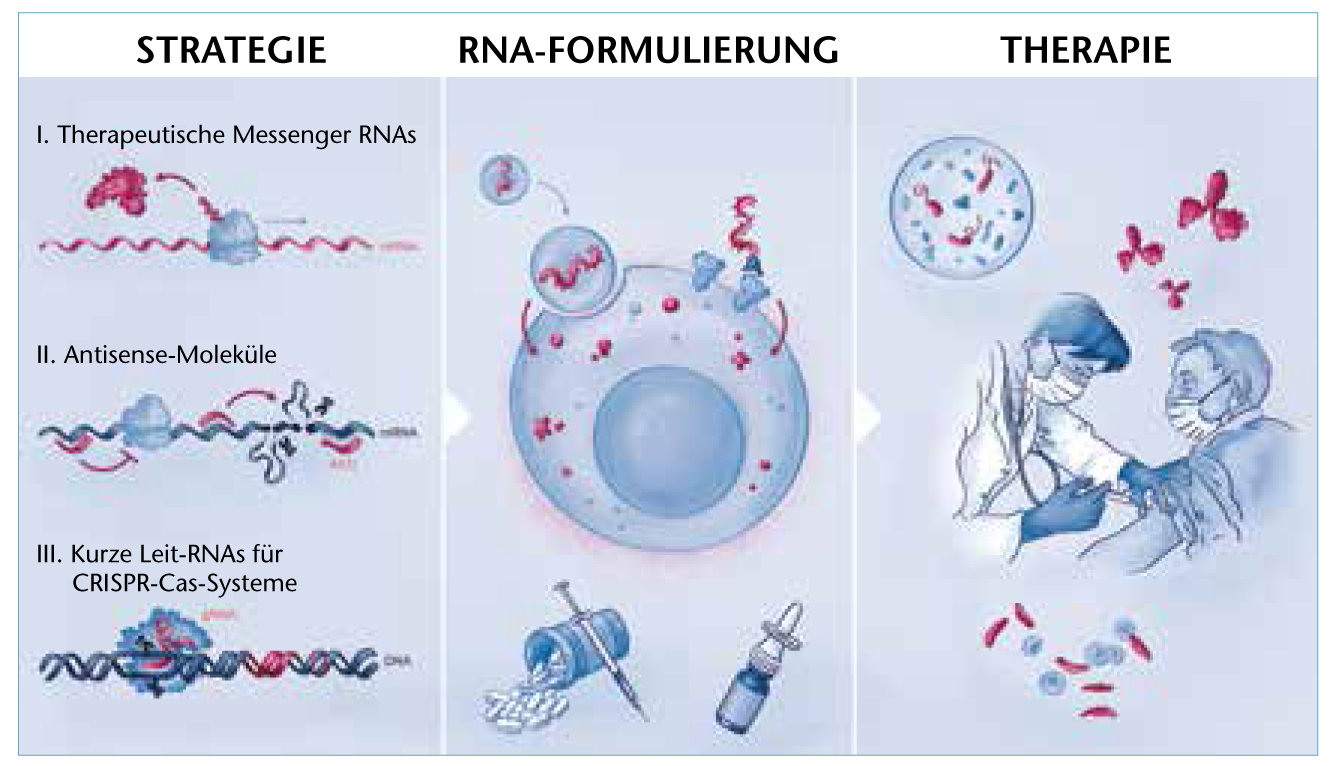
© SciGraphix/Sandy Westermann
Die moderne RNA-Medizin nutzt unter anderem therapeutische mRNA, Antisense-Strategien und CRISPR-Cas-Systeme zur Behandlung unterschiedlicher Krankheiten.
Wie lässt sich das Wundermolekül medizinisch nutzen?
Auf zweierlei Weise: in modifizierter Form als Wirkstoff und, wenn es um körpereigene RNA geht, als Angriffspunkt für maßgeschneiderte Wirkstoffe. mRNA-Impfungen sind ein gutes Beispiel für das erste Wirkprinzip. So enthält etwa der Corona-Impfstoff von Biontech/Pfizer eine im Labor erzeugte mRNA-Variante des Stachelproteins von SARS-CoV-2. Nach der Impfung erzeugt der Körper diese Stachelprotein-Variante, was eine starke Immunantwort hervorruft. Der Impfstoff funktioniert als Antigen, das die Bildung von Antikörpern durch das Immunsystem anstößt. In ähnlicher Weise will man das Immunsystem mithilfe gezielt veränderter RNA zur Produktion von Antikörpern gegen Krebszellen anregen. Dazu laufen bereits etliche Studien. Man könnte auch die Lungenzellen von Mukoviszidose-Patienten mithilfe der CRISPR-Cas-Methode so verändern, dass sie ein lebenswichtiges Protein in der korrekten Form herstellen. Welche dieser Therapien sich unter medizinischen und Kosten-Gesichtspunkten durchsetzen wird, kann man heute noch nicht absehen.
Bitte erläutern Sie auch das zweite Wirkprinzip an einem Beispiel.
In der Herzmedizin wird beispielsweise daran geforscht, die Produktion krankmachender Proteine durch künstlich hergestellte siRNA zu unterbinden. Dafür werden RNA-Schnipsel im Labor erzeugt, die genau komplementär zur Sequenz der körpereigenen RNA aufgebaut sind – sogenannte Antisense-Moleküle. Die Idee ist, sie an kleine Fettbläschen zu koppeln und unter die Haut zu spritzen. Diese Liposomen sollen ins Herz gelangen, um ihre siRNA-Fracht in die Zellen einzuschleusen. Die Fracht, so der Plan, dockt an der körpereigenen RNA an und legt sie lahm. Auf ähnliche Weise könnte man nicht-kodierende RNA, die im Körper zwar keine Proteine herstellen, dafür aber viele Prozesse regeln, bei Fehlfunktionen in die gewünschte Richtung lenken.
Was kann, kurz gesagt, die RNA-Medizin, das herkömmliche Wirkstoffe nicht können?
Ein großer Vorteil ist die Programmierbarkeit: Wirkstoffe lassen sich exakt nach Bedarf entwerfen. Ein weiterer Vorzug ist die Geschwindigkeit. Man kann ein Therapeutikum am Bildschirm in Minutenschnelle entwerfen und danach zügig herstellen, wenn die Produktionskapazität da ist. Denken wir an die mRNA-Impfstoffe, die ja sehr schnell zur Verfügung standen.

© RVZ
Alt und neu in ästhetischer Verbindung: Die umgebaute und erweiterte frühere Chirurgische Klinik der Würzburger Universität beherbergt jetzt zwei Forschungszentren, das Helmholtz-Institut für RNA-basierte Infektionsforschung und das Rudolf-Virchow-Zentrum für Experimentelle Biomedizin.
Aber bewirken RNA-Therapien auch genau das, was sie sollen?
Sie sind sehr spezifisch. Vielleicht sogar spezifischer als herkömmliche Arzneimittel, die gegen Proteine gerichtet sind. Zu tun hat das mit der exakten Basenpaarung bei Nukleinsäuren.
Und wenn gravierende Nebenwirkungen auftreten: Lässt sich die RNA wieder zurückholen?
Das wissen wir noch nicht genau. Bisher war es nicht nötig, weil die mRNA schnell wieder aus dem Körper verschwindet. Für die Zukunft werden wir uns aber etwas überlegen müssen. Bis jetzt ist es nur eine Forschungsidee, Depots mit Ersatzproteinen im Körper anzulegen. Aber wenn das gelingt, muss man natürlich Schutzmechanismen für den Fall von Unverträglichkeiten bereithalten. Ein prinzipielles Problem sehe ich aber nicht, denn man könnte auch hier ein Gegenmittel entwerfen. Etwa ein Anti-CRISPR-Cas-Molekül, das bei Bedarf verabreicht wird.
Anders als heutige Medikamente ist RNA sehr instabil. Wie verhindert man, dass sie im Körper schnell zerfällt und wirkungslos bleibt?
Dafür muss man ihre chemische Struktur verändern. Ein passendes Beispiel liefert wieder der mRNA-Impfstoff. Dass er so gut wirkt, ist der Biochemikerin Katalin Karikó zu verdanken. Sie hat schon weit im Vorfeld zusammen mit dem Immunologen Drew Weissmann eine Variante der Base Uridin, das Pseudouridin, in die mRNA eingebaut. Das macht das Molekül nicht nur stabiler und effizienter, es reduziert auch das Risiko von Überreaktionen des Immunsystems.
Eine Pionierleistung, die die rettenden Impfstoffe erst ermöglichte?
Ja, und ganz bestimmt nobelpreisverdächtig. Wenn man Versuche mit nicht-modifizierter mRNA dagegenhält, dann zeigt sich, dass es ohne diese Modifikation nicht geht. Das ist der Grund, warum manche andere Impfstoffkandidaten bisher gescheitert sind.
Lassen Sie uns ein paar technische Fragen klären. RNA-Moleküle sind groß und sehr negativ geladen. Wie bekommt man sie im Körper dorthin, wo man sie haben will?
Bei der mRNA-Impfung funktioniert das ja sehr gut: Der in den Oberarmmuskel gespritzte Impfstoff wird im Muskel von bestimmten Immunzellen aufgenommen und führt von dort aus direkt zur Immunantwort. Es wird aber, wie schon erwähnt, auch über Depots in der Nähe von Zielorganen wie Lunge, Leber oder Nieren nachgedacht. Sprays sind ebenfalls in der Diskussion. Insgesamt ist das gerade ein großes Forschungsthema. Wichtig ist dabei immer auch die Compliance: Wie gut wird die Therapie von Patienten angenommen und wie treu bleiben sie ihr – all das spielt eine Rolle.
Heute werden RNA-Moleküle vor allem in Lipide verpackt, um sie in die Zellen zu schleusen. Ist das die beste Methode?
Derzeit ja. Erprobt werden auch Nanocages, die man sich als Käfige aus DNA zum Transport der RNA vorstellen kann. Es kommt vor allem darauf an, die vergleichsweise großen RNA-Moleküle vor den Attacken des Immunsystems und dem Abbau durch Enzyme zu schützen – an diesen Kriterien müssen sich alle Verfahren messen lassen.
Wie lange hält die Wirkung einer RNA-Therapie an?
Das kommt auf die Technologie an. Bei der mRNA-Therapie wird das Protein, ähnlich wie bei der Corona-Impfung, nach Verabreichung für einige Tage hergestellt – danach ist die mRNA abgebaut. Das Protein wiederum kann Tage bis Wochen im Körper existieren und seine Wirkung entfalten, bis es dann ebenfalls abgebaut wird. Ein Beispiel: Bei der Therapie der Spinalen Muskelatrophie SMA müssen die Medikamente, die die mRNA-Reifung fördern, alle zwei bis vier Monate gegeben werden.
Wie weit ist die Erprobung am Menschen?
Mit am weitesten fortgeschritten ist eine CRISPR-Cas-Studie mit einem RNA-Wirkstoff zur Behandlung der Erbkrankheit Beta-Thalassämie. Bisher benötigen die Patienten regelmäßige Bluttransfusionen. Wenn die neue Therapie sich bewährt, ist das nicht mehr nötig. Dann produziert ihr Körper das fehlende Hämoglobin. In der klinischen Prüfung sind auch neue Impfstoffe auf mRNA-Basis, etwa gegen Influenza oder Malaria.

© HIRI / Luisa Macharowsky
An der anaeroben Werkbank im Labor des Helmholtz-Instituts für Infektionsforschung mit Professor Jörg Vogel (links).
Warum ist die RNA-Medizin erst jetzt ein großes Thema geworden?
Es brauchte die Pandemie, um Druck aufzubauen. Sie hat den nötigen Schub gebracht und gezeigt, dass mRNA-Impfstoffe und die RNA-Medizin insgesamt wirksam und sicher sind.
Sie gelten als Pionier der RNA-Medizin. Was hat Sie in diese Richtung gebracht?
Ich habe Biochemie studiert und schon als Student in molekularbiologischen Laboren gearbeitet, unter anderem in der Pflanzengenetik. Dort habe ich dann auch promoviert, und zwar über molekulare Mechanismen von katalytischen RNA-Molekülen in den Chloroplasten der Gerste.
Seit mehr als fünf Jahren leiten Sie das Helmholtz-Institut für RNA-basierte Infektionsforschung. Wo stehen Sie heute?
Das Institut hat sich prächtig entwickelt, und zwar parallel zur wachsenden Bedeutung der RNA-Forschung. Als wir anfingen, dachte man beim Thema Impfstoffe noch in erster Linie an Proteine als Wirkstoffe, nicht an RNA. Das hat sich in den letzten Jahren gründlich geändert. Innovationen erwartet man heute vor allem von der RNA-Forschung. An unserem Institut profitieren wir sehr von der Hochdurchsatzsequenzierung: Dadurch können wir wie mit einem Mikroskop in die Zellen hineinschauen und sehen, welche RNA gerade produziert werden. Mittlerweile sind wir auch ziemlich gut darin, die RNA so zu modifizieren, dass sie medizinisch nützlich ist.
Ist der medizinische Nutzen ein großes Thema bei Ihnen?
Wenn es um neue Ansätze geht, ja. Aber wir sind Grundlagenforscher. Die Weiterentwicklung ist Sache der Industrie.
Arbeitet Ihr Institut mit Pharmafirmen zusammen?
Bisher kaum, aber das soll sich ändern. Derzeit bereiten wir die erste Ausgründung vor. Es geht um RNA-basierte Diagnostik und um Tests, die viele verschiedene Erreger gleichzeitig nachweisen können.
Gegen die gewöhnliche Erkältung ist bislang kein Kraut gewachsen. Ob die RNA-Medizin damit fertig wird?
Warum nicht? Ideen hätten da schon!
Eine kürzere Version dieses Interviews findet sich in der Festschrift zum 200-jährigen Bestehen der GDNÄ „Wenn der Funke überspringt“, Leipzig 2022, ISBN 978-3-95415-130-1.

© HIRI
Die RNA-Biologie ist sein Forschungsschwerpunkt: Professor Jörg Vogel
Zur Person
Jörg Vogel ist Professor für Molekulare Infektionsbiologie und Gründungsdirektor des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) in Würzburg. Das Institut wird als Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung zusammen mit der Universität Würzburg betrieben. Es ist das weltweit erste Institut, das RNA-Biologie und Infektionsforschung zusammenbringt. Parallel leitet Jörg Vogel das Institut für Molekulare Infektionsbiologie an der Universität Würzburg. Für seine Arbeiten zur RNA-Biologie erhielt er 2017 den Leibniz-Preis der Deutschen Forschungsgemeinschaft.
Ribonukleinsäure (RNA)
Als mRNA sorgt die Ribonukleinsäure (RNA) dafür, dass die in der DNA gespeicherten Information in die lebensnotwendigen Proteine umgesetzt werden. Andere RNA-Klassen regulieren die Aktivität der Gene oder haben katalytische Funktionen. Im Aufbau ähnelt die RNA der DNA. Im Unterschied zu dieser ist sie in der Regel einsträngig, was sie zwar weniger stabil aber auch chemisch vielseitiger als DNA macht. Mit der RNA begann auf der Erde die chemische Evolution – aus ihr haben sich wahrscheinlich alle Organismen entwickelt.
